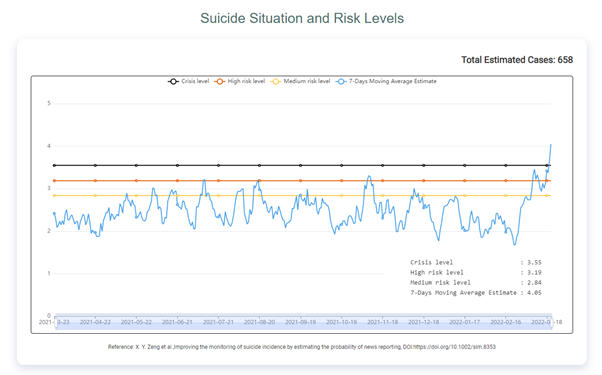
Peter小组(IBC)的EMBO报告发现人类GID E3泛素连接酶与两个不同的底物招募模块形成四聚体复合体,即WDR26-RanBP9和GID4-ARMC8a。虽然较短的ARMC8b亚型可以稳定地组装到hGID复合体中,但它缺乏招募GID4底物受体的能力。
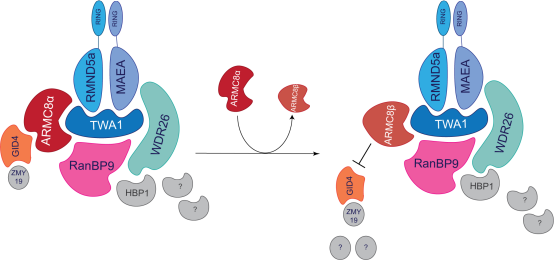
人类GID (hGID)复合体是一种保守的E3泛素连接酶,调节包括葡萄糖代谢和细胞周期进展在内的多种生物过程。然而,对多亚基复合体的生化功能和底物识别仍知之甚少。通过生化分析、交联质谱和低温电子显微镜,我们发现hGID参与了两种不同的底物补充模块,依赖于WDR26或GID4。WDR26和RanBP9在体外协同泛素化HBP1,而GID4在此反应中是不需要的。相比之下,GID4作为基板ZMYND19的适配器,令人惊讶的是,它缺乏Pro/ n端规则degron。GID4底物结合和连接酶活性受ARMC8a调控,而较短的ARMC8b亚型组装成稳定的hGID复合物,无法招募GID4。这些hGID复合物的低温电镜重建揭示了WDR26在环状四聚体结构中的定位,表明GID4和WDR26/Gid7利用不同的、不重叠的结合位点。总之,这些数据促进了我们对hGID复合体如何招募同源底物的机制的理解,并为其E3连接酶活性的调节提供了见解。
链接到“EMBO报告”中的论文。